首页 > 财经新闻/ 正文
进行性核上性麻痹是一种与tau蛋白聚集相关的神经退行性疾病。Tilavonemab(ABBV-8E12)是一种与人tau蛋白N端结合的单克隆抗体。本研究评估Tilavonemab治疗进行性核上性麻痹的安全性和有效性。
这是一项在澳大利亚、加拿大、法国、德国、意大利、日本、西班牙和美国的66家医院和诊所中开展的随机、安慰剂对照、双盲的2期研究。招募≥40岁确诊或疑诊发生了进行性核上性麻痹的受试者,且要求症状出现时间不到5年,有可靠的研究伙伴,能够在最小限度的帮助下步行5步。受试者被随机分至三组(1:1:1),分别在第1、15和29天静脉注射Tilavonemab2000 mg、4000 mg或匹配的安慰剂,然后每28天重复给药一次,共25周。主要终点是意向治疗人群中进行性核上性瘫痪评定量表(PSPRS)总分的变化。
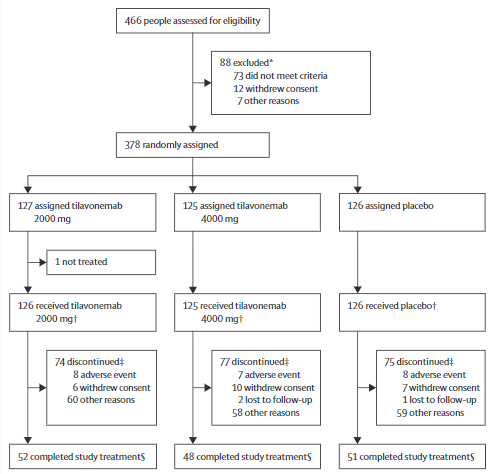
研究流程
2016年12月12日-2018年12月31日期间,共有378位患者被随机分组。因第二次中期分析符合预先指定的无效标准,该研究于2019年7月3日终止。
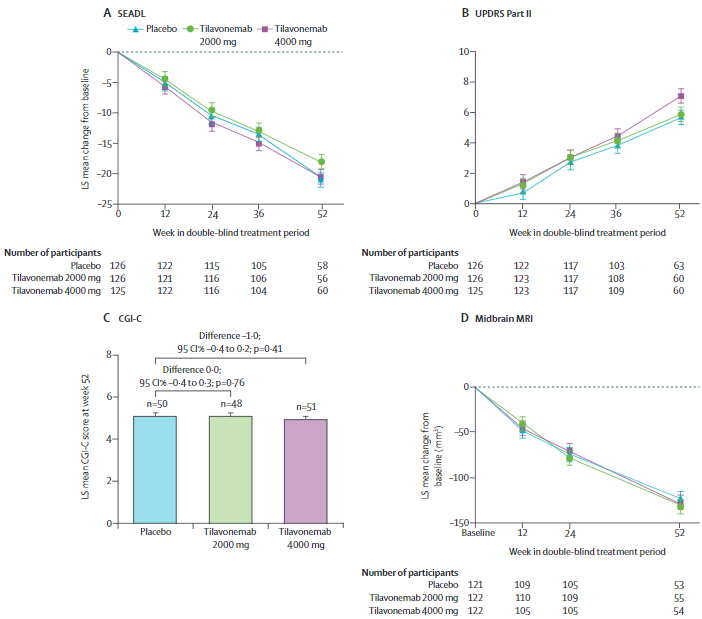
治疗前后PSPRS的变化
共有377名受试者至少接受了一剂研究药物,被纳入疗效和安全性分析(2000 mg组,n=126;4000 mg组,n=125;安慰剂组,n=126)。从基线到第52周,各组PSPRS的最小二乘均值变化相近(与安慰剂相比的组间差异:2000 mg组 0.0[95%CI-2.6~2.6],效应大小为0.000,p>0.99;4000 mg组 1.0[-1.6~3.6],-0.105,p=0.46)。
治疗前后次要终点的变化
大多数受试者报告了至少一次不良事件(2000mg组 111例[88%];4000 mg组 111例[89%];安慰剂组108例[86%])。跌倒是最常见的不良反应(2000 mg组 42例[33%];4000 mg组 54例[43%];安慰剂组 49例[39%]),还是最常见的紧急治疗严重不良事件(4% vs 5% vs 5%)。各组严重不良事件的发生率相似(23% vs 27% vs 26%)。研究期间发生了26例死亡(2000 mg组 9例[7%];4000 mg组 9例[7%];安慰剂组 8例[6%]),但无一例与药物有关。
综上所述,在本研究的所有治疗组中都观察到相似的安全性特征。未记录到有益的治疗效果。虽然这项研究没有提供Tilavonemab用于进行性核上性麻痹有疗效的证据,但这些发现为未来使用tau抗体被动免疫治疗进行性核上性瘫痪提供了潜在的有用信息。
原始出处:
Hoglinger Günter U,Litvan Irene,Mendonca Nuno et al. Safety and efficacy of tilavonemab in progressive supranuclear palsy: a phase 2, randomised, placebo-controlled trial. Lancet Neurol, 2021, 20: 182-192.
- 搜索
-
- 1000℃游族网络:董事长林奇逝世 公司将尽快推举董事长人选
- 1000℃20年来首次!民生银行高管集体增持 重磅信号浮现?招商、中信高管也岀手 机构火线解读
- 1000℃?第二季! 被解散的董事会秘书公开反击,请愿书要求取消董事会决议国信金融控股回应:将积极回应
- 1000℃?“环球银行”行长顾Shu接任周母兵,并将成为四大银行中最年轻的董事长。 高级会计专家如何指导中国农业银行?
- 1000℃?阿里巴巴股票持续下跌
- 1000℃?400亿铅电池领导者天能股份在科技创新局,“永进”,硅谷天堂等明星股东上市
- 1000℃?德意志银行成为北京首家获准托管证券投资基金的外资银行
- 1000℃?顾Shu担任农业银行党委书记,将成为四大银行中最年轻的董事长
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)