首页 > 财经新闻/ 正文
最近,上海君实生物科技有限公司(Junshi Biosciences)宣布其PD-1 /TGF-β双功能融合蛋白JS201注射液(JS201)的临床试验申请已被中国国家药品管理局(NMPA)接受。
JS201是君实生物使用其专有技术开发的一种双功能融合蛋白,可以同时靶向PD-1和TGF-β(转化生长因子-β)。JS201是首个获准在中国进行临床试验的靶向PD-1/TGF-β的产品。JS201可有效阻断PD-1和TGF-β的免疫抑制途径,提高肿瘤微环境中的免疫调节作用,从而增强患者免疫系统对肿瘤细胞的杀伤作用、减少免疫逃逸和耐药性的发生。
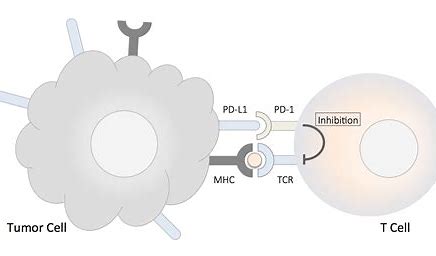
Junshi Biosciences是中国第一家获得抗PD-1单克隆抗体销售许可的中国制药公司。其针对实体瘤的人类首创抗BTLA抗体是世界上第一个被FDA和NMPA批准用于临床试验的抗体。其抗PCSK9单克隆抗体是NMPA在中国批准的第一项临床试验。2020年初,Junshi Biosciences与中国科学院微生物研究所和礼来公司共同开发了JS016,这是中国首个针对SARS-CoV-2的完全人源单克隆抗体,现已进入临床试验。
目前,Junshi Biosciences在美国(旧金山和马里兰州)和中国(上海、苏州、北京和广州)拥有2,000多名员工。
原始出处:
https://www.firstwordpharma.com/node/1807148?tsid=4
猜你喜欢
- 埃斯顿:预计可完成全年机器人出货量5000-6000台目标
- 四会富仕前三季度净利同比增48% 加速推进新产能建设
- 丽珠医药(01513)生产的苯磺酸氨氯地平胶囊通过仿制药质量和疗效一致性评价
- ?BMO Capital Markets:将迪士尼(DIS.US)的目标价格上调至185美元,并将其评级下调为“与市场同步”
- 给农村孩子“加餐”投资价值不可低估
- 恒大物业准备下周一启动IPO 募资20亿美元
- 欧佩克技术委员会建议推迟增产 全球原油市场遭遇疫情二次冲击
- 招商局置地:与中国五矿北京设立项目公司共同开发广州地块
- ?茅台股价再创新高A股涨价逻辑是什么
- 超10万用户隐私泄露 包括名字、电邮、电话……这家电脑设备巨头道歉了!
- 搜索
-
- 1000℃游族网络:董事长林奇逝世 公司将尽快推举董事长人选
- 1000℃20年来首次!民生银行高管集体增持 重磅信号浮现?招商、中信高管也岀手 机构火线解读
- 1000℃?第二季! 被解散的董事会秘书公开反击,请愿书要求取消董事会决议国信金融控股回应:将积极回应
- 1000℃?“环球银行”行长顾Shu接任周母兵,并将成为四大银行中最年轻的董事长。 高级会计专家如何指导中国农业银行?
- 1000℃?阿里巴巴股票持续下跌
- 1000℃?400亿铅电池领导者天能股份在科技创新局,“永进”,硅谷天堂等明星股东上市
- 1000℃?德意志银行成为北京首家获准托管证券投资基金的外资银行
- 1000℃?顾Shu担任农业银行党委书记,将成为四大银行中最年轻的董事长
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)